Canlılarda Direnç Evrimi
Doç. Dr. Meral KENCE
Orta Doğu Teknik Üniversitesi Fen Edebiyat Fakültesi Biyoloji Bölümü, Ankara
Direnç, geniş anlamda bir populasyondaki bireylerin çevrelerindeki zararlı etmenlere karşı kalıtsal uyumları ile yaşamda kalabilme yetisi olarak tanımlanabilir.
Canlılarda direnç evrimine prokaryotlardan ökaryotlara çok farklı taksonomik gruplarda pek çok örnek vardır ve bunlar süregiden evrim örneğidirler:
1. Mikroorganizmalarda antibiyotiklere direnç
2. Böceklerde, böcek öldürücülere (insektisit) direnç
3. Hastalık yapıcılara (patojen) karşı direnç
3.a. Omurgalı hayvanlarda MHC, insanda HLA genleri
3.b. Insanda bir alıcı (reseptör) kodlayan CCR5 geni ve hastalıklara direnç
3.c. insanda sıtmaya karşı direnç 4. Bitkilerde direnç
Bu örneklerin tümünde, mutasyon ve seçilim yoluyla evrim gözlenmektedir.
Canlıların genomunda ortaya çıkan bazı mutasyonlar (kalıtsal değişimler) değişen çevre koşullarında ya da mevcut zararlı etmenlere karşı yaşam savaşında yarar sağlayabilmekte, bu mutant genleri taşıyan bireyler yaşayabilmekte ve üreyerek genlerini sonraki kuşaklara aktarabilmektedirler. Böylece canlı topluluklarında genetik yapı değişimleri ortaya çıkmakta, canlı toplumu farklılaşmaktadır ve bu oluşum mikroevrim olarak tanımlanmaktadır.
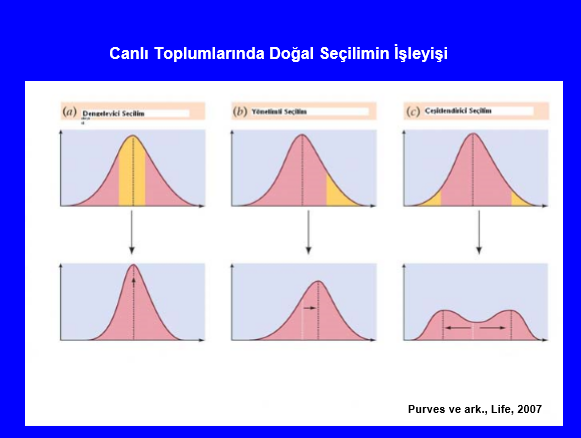
Canlı toplumlarında seçilim farklı şekillerde olabilmektedir. a)dengeleyici seçilim, b)yönelimli seçilim, c)çeşitlendirici seçilim (Şekil 1). Dengeleyici seçilimde ortalama değerlere sahip genotipler seçilmekte ve bir sonraki generasyonda ortalama değişmemekte fakat varyasyon azalmaktadır. Yönelimli seçilimde dağılımın bir ucundaki genotipler seçilmekte bunun sonucu olarak bir sonraki kuşakta ortalama sağa kaymakta, varyasyon ise karakterin özelliğine ve seçilim baskısının büyüklüğüne bağlı olarak değişmekte veya ayni kalmaktadır. Çeşitlendirici seçilimde ise dağılımın iki ucundaki genotipler avantajlı olmakta ve seçilmektedirler, bir sonraki kuşaktaki genotiplerin oluşturduğu iki farklı ortalama ve varyasyon değerli dağılım ortaya çıkmaktadır.
1. Mikroorganizmalarda antibiyotiklere direnç
Antibiyotik direnci mikroorganizmalarda içsel (intrinsic) veya sonradan kazanılmış olabilmektedir. İçsel direnç örneğin hücre duvarlarında peptidoglikan bulunmayan Mycoplasma hücre duvarını hedef alan antibiyotiklere (β-lactam) dirençli olmaktadır. Pseudomonas aeruginosa, dış zarın kısıtlı geçirgenliği ve kromozomunda β-lactamase geni bulunması nedeniyle içsel dirence sahiptir.
Antibiyotiklere kazanılmış direnç ise bakteri genomundaki mutasyonlarla (nokta mutasyonları, eksilmeler (delesyon) veya eklenmeler (insersiyon) veya yatay gen transferi ile ortaya çıkmaktadır. Yatay gen transferi, konjugasyon ile, direnç genleri taşıyan plazmidler ya da ayni ya da farklı mikroorganizma türleri arasında transdüksiyon ve transformasyon ile veya transpozonlarla gerçekleşmektedir (Şekil 2). Bu elemanlar rekombinazları ve entegrazları kullanarak bakteri genomuna DNA, yani genetik bilgi eklemekte, böylece dirençli bir bakteri hücresi direnç genlerini duyarlı hücrelere hızla yayabilmektedir (Normark & Normark, 2002). Yoğun antibiyotik kullanılması da güçlü bir seçilim baskısı oluşturduğundan kısa zamanda çok dirençli soylar ortaya çıkmaktadır. Aşırı antibiyotik kullanılması genellikle yüksek düzeylerde direnç ile bağlantılı bulunmaktadır. Bir örnek verecek olursak, zatürre, menenjit ve orta kulak enfeksiyonuna neden olan mikroorganizma Steptococcus pneumoniae’ya karşı 1940larda penisilin kullanılmaya başlandı ancak 1960larda direnç saptandı ve S. pneumoniae’da direnç küresel bir sorun olarak insanları tehdit etmektedir, bazı toplumlarda direnç düzeyleri ciddi boyutlardadır. Son savunma silahı olarak görülen Vancomycin’e direnç bazı enterokok bakterilerinde saptanmış olup pnömokok türü bakterilere yatay gen transferi ile geçmesi ve yayılması yaşamı tehdit eden enfeksiyonlarda bu antibiyotiğin de etkisiz kalacağı öngörülmektedir (Gilmore & Hoch,1999; Bunch & Baines,1997).
Antibiyotik direncinin artan yayılışı evrimin sonucudur; bu ilaçların kullanılmasıyla bakteri toplumlarında doğal olarak bulunan antibiyotiklere dayanıklı bireylerin seçilmesi yoluyla sayıları artmakta ve baskın mikroorganizma olmaktadırlar. “ bulunduğu çevreye en uyumlunun yaşaması” antibiyotik direnci örneğinde de gözlenmektedir.
Bakterilerin direnç geliştiremediği hiçbir mikrop öldürücü ilaç örneği yoktur.
Direnç kazanmanın mikroorganizmaya bir bedeli olabilmekte, ancak bunu telafi edici mutasyonların hızla birikmesi bu uyum bedelini ortadan kaldırmaktadır (Normark&Normark, 2002). Bu saptama bir bakteri populasyonunda birçok direnç tiplerinin asla kaybolmamasını açıklamaktadır. Örneğin, bir bakteri topluluğunun antibiyotiğe direnç kazanması o bakterinin yavaş gelşip çoğalmasına neden olsa, bu bir bedeldir bir uyum eksilmesidir, ancak ölüm-kalım savaşında başarıdır, yavaç gelişse bile varlığını sürdürebilmektedir. Duyarlılığı sürse antibiyotikli ortamda hiç yaşayamayacak ve yok olacaktı.
Direncin nasıl evrimleştiğini ve yayıldığını bilmek, genetik ve fizyolojik mekanizmalarını anlamak, yeni geliştirilecek antibiyotiklere de direncin evrimleşmesini önlemek ya da yayılmasını engellemek için neler yapılabileceğini kestirmek evrimsel bilginin ışığında olanaklıdır ve bu bilgi bundan sonraki yaklaşımlarımızda yararlı ve yol gösterici olacaktır. Örneğin aşılar, enfeksiyonların sıklığını azaltarak dolaylı olarak antibiyotik kullanımını azaltacaktır, böylece antibiyotiklere karşı mikroorganizmalarda direncin evriminin önlenmesi ve hatta geri döndürülmesinde önemli bir rol oynayabilir. Öte yandan bulaşıcı hastalıkların kontrolu, gelişmiş sıhhi temizlik, doğru antibiyotik kullanımı gibi uygulamalar da buna katkı sağlayacaktır.
2. Böceklerde böcek öldürücülere direnç de, antibiyotik direnci gibi, insan eliyle yapılmış önemli bir doğal seleksiyon ile evrim örneğidir. böceklerde böcek öldürücülere direncin evrimi, Darwin’in “en uyumlunun yaşaması” (survival of the fittest) kuramını en etkin doğrulayan oluşumdur.
500den fazla dirençli böcek türü (en az bir böcek ilacına dirençli) saptanmış bulunmaktadır (Georghiou & Lagunes-Tejeda, 1991; Futuyma, 2007). Bunların çoğu tarım zararlıları ve insan sağlığını tehdit eden hastalık etmenlerinin taşıyıcıları olan böceklerdir. 71 sentetik kimyasal böcek ilacına karşı dirençlilikle bir afid türü, Myzus persicae (Sulzer) (Homoptera: Aphidae) şampiyon durumda olup 51 kimyasala karşı dirençle lahana yaprak güvesi, Plutella xylostella L. (Lepidoptera: Plutellidae) ikinci sırada, 37 kimyasala direnç kazanan Colorado patates böceği, Leptinotarsa decem-lineata (Say) (Coleoptera: Chrysomelidae) 3. sırada yer almaktadır (Georghiou & Lagunes-Tejeda, 1991). Salmonella, Shigella, E. coli gibi bakteriler için taşıyıcı olan karasinek, Musca domestica ve s ıtma parazitini taşıyan Anopheles cinsi sivrisineklerin birçok türü de bu yarışta önde gitmektedirler.
Direnç nasıl ortaya çıkmaktadır? Direncin evriminde rol oynayan gen sayısı nedir? Direnç genlerindeki mutasyonların sayısı nedir? Sorularına “insect genomics” teki gelişmeler yanıt verebilmekte ve karmaşık metabolik sistemlerin anlaşılmasını kolaylaştırmaktadır.
Direncin işleyiş yolları (mekanizmaları): Böcek öldürücünün emiliminin azaltılması Hedef enzimin böcek öldürücüye duyarlılığının azalması (hedef enzimin değişmesi) Böcek öldürücünün artan detoksifikasyonu
Bu işleyiş yollarından en etkili ve en yaygın olanları, hedef enzimin böcek ilacına duyarlılığının azalması ve ilacın artan detoksifikasyonudur.
Organofosfat (OP) ve karbamat böcek öldürücülerin hedef enzimi Asetilkolinesteraz (AChE)dır. Bu enzimin görevi sinapslarda bir nörotransmiter olan asetilkolini (Ach) hızla hidrolize ederek birikmemesini sağlamaktır. Organofosfat ve karbamat insektisitler asetilkolinesterazı inhibe ederek asetilkolinin sinapslarda birikmesine neden olmakta, bunun sonucunda sürekli uyarılmadan dolayı böcek çok fazla enerji harcamakta ve tükenip ölmektedir. AChE enzimindeki kantitatif ve kalitatif değişmeler dirence neden olmaktadır. Merkezi sinir sistemindeki asetilkolinesteraz düzeyi ile OP direnci arasında korelasyon saptanmıştır (Fournier et al., 1992;1993). Enzimin fazla üretimi böceği OP zehirlenmesine karşı korumaktadır. Asetilkolinesteraz enzimini kodlayan Ace genindeki nokta mutasyonları ise bu enzimi insektisitlere duyarsız hale getirmekte, böylece insektisit etkisiz kalmaktadır. Örneğin Phe115 - Ser, Ileu199 - Val, Gly303 - Ala ve Phe368 - Tyr Gly227Ala mutasyonları Drosophila’da (Fournier et al.1993), karasinekte (Walsh et al., 2001), sivrisinek ve afidlerde (Nabeshima et al.,2004) , afid (Nabeshima et al., 2003) , bir güve türünde, Plutella xylostella L.(Ni et al., 2003) saptanmıştır. Drosophila (Fournier et al.1993) ve ipek böceğinde de bu mutasyonların bulunması (Seino et al., 2007) hedef olmayan bu türlerin de etkilendiğini ve direnç geliştirdiğini göstermektedir. Asp to Ala (150), Ile to Leu (153), Thr to Ser (165), Glu to Gln (218) and Met to Ile (227) saptanan diğer amino asit değişimleridir (Tomita et al., 1995).
Metabolik direnç: sitokrom P450ler, karboksilesterazlar (KOE), glutatiyontransferazlar (GST) insektisit metabolizmasında önemli rol oynayan enzimlerdir.
Sivrisineklerde (Anopheles gambiae) çarpıcı olan, bu enzimleri kodlayan genlerin sayılarının artmış ve kümeler oluşturmalarıdır. Örneğin A. gambiae’da 111 P450, 51 KOE, 31 GST geni saptanmıştır (Ranson et al., 2002). Bu genlerde yüksek nükleotid dizilimi benzerliği bulunmaktadır, örneğin, iki P450 geninin nükleotid benzerliği %99.3 bulunmuştur. Bu kopyalardan bazıları insektisit direncinde rol oynamakta, bazıları böceklerde temel fizyolojik işlevleri yerine getirmektedirler. Bazı dirençli afid soylarında, gen kopyalarının artması ve artan gen ifadesi ile 70 kat fazla esteraz üretimi saptanmıştır. Ayrıca bu genlerde evrim sürecinde kopyalanma(duplication) dan sonra meydana gelen nokta mutasyonları ile bir veya birkaç amino asit değişimi ile herbir gen ürünü bir maddeye (substrat) özgünlük kazanmaktadırlar.
Türkiye’deki karasineklerle yapılan bir araştırmada bir karboksilesteraz kodlayan MdαE7 genindeki bir mutasyonun enzimde Trp251→Ser değişimine neden olduğu, bunun malation direncinde rol oynadığı saptanmıştır. Duyarlı referans soyuna kıyasla 600 kat dirençli karasinek toplumlarında ayrıca yüksek GST ve AChE aktiviteleri birden fazla direnç mekanizmasının birarada bulunmasıyla yüksek malation direncinin ortaya çıktığını ve bu böcek ilacının etkisiz kaldığını göstermektedir (Taşkın & Kence, 2004).
3. Hastalık yapıcılara (patojen) karşı direnç
3.a. Omurgalı hayvanlarda MHC, insanda HLA genleri Omurgalı hayvanlarda MHC, insanda HLA genleri, hastalık yapıcı etmenlere karşı vücudu koruyan, bağışıklık yanıtı veren, bir başka deyişle direnç sağlayan molekülleri üretir. İnsan genomunda en değişken lokuslar olarak bilinen HLA grupları HLA-A, HLA-B, HLA-DR1 lokuslarında sırasıyla 243, 499 ve 321 alel saptanmıştır (Garrigan & Hedrick, 2003). Bu büyük çeşitlilik, hastalık yapıcı etmenlerin çeşitliliğine karşı bir uyarlanmadır. Diğer HLA lokuslarında da fazla sayıda alel bulunmaktadır.
3.b. Insanda bir alıcı (reseptör) kodlayan CCR5 geni ve hastalıklara direnç CCR5 ve hastalıklara direnç: alıcı 5 kodlayan CCR5 geninde meydana gelen 32 baz çiftinin Delesyonu (∆32) bu alıcıyı işlevsiz kılmakta ve bu delesyonlu gen bakımından homozigot olan bireyi HIV enfeksiyonuna karşı dirençli yapmaktadır; heterozigotlarda ise AIDS hastalığının başlamasını geciktirmektedir. Bu alelin coğrafik dağılımına bakıldığında kuzey Avrupa’da % 16, güney Avrupa’da %4 sıklıkta olduğu ve Afrika ve Asya örneklerinde bulunmadığı görülmektedir (Şekil xx). Bilim insanları HIV enfeksiyonlarının çok yakın geçmişte başladığından hareketle bir mutasyonun bu kısa sürede böyle yüksek sıklığa ulaşamayacağını ve seçilimin çok daha önceleri, başka bir hastalık etmenine direnç sağlaması sonucunda artmış olabileceği varsayımını sınadılar. Bunun için CCR5 geni yakınlarındaki iki mikrosatelit lokusunun gözlemlenen bağlantı dengesizliği değerini kullanarak 32 bç delesyonun yaşını 700 yıl olarak hesapladılar ve bunun vebaya ya da çiçek hastalığına direnç ile bağlantısını tahmin ettiler. 2005te 2900 yıllık Tunç devri iskelet örnekleri üzerinde yapılan bir araştırmada bu delesyonun sıklığının %12 olduğu görüldü. Bağlantı grubu mikrosatellit haritası ve 32 SNP belirteçleri kullanılarak yapılan bir başka araştırma da delesyon yaşını 5075 olarak belirledi (Tunç devrine denk gelir). Bu çalışmalar delesyonun veba salgınından ve çiçek hastalığının yaygın olduğu zamanlardan daha önce ortaya çıkmış olduğunu gösterdi. Bu da bu delesyonun genel olarak bulaşıcı hastalıklara karşı direnç sağladığını ortaya koymaktadır (Hedrick, 2006).
3.c. insanda sıtmaya karşı direnç: Dünya Sağlık örgütü her bir dakikada 2 insanın sıtma hastalığından yaşamını yitirdiğini bildirmektedir. En çok da Güneydoğu Asya ve Afrika’da (yılda bir milyon çocuk) can almakta olan sıtma, insanın yakın tarihinde en güçlü seçilim baskısı oluşturan hastalıktır. DDT, II. Dünya Savaşı sırasında kullanılmaya başlanmış ancak biyobirikim, çevre kirliliği ve hedef olmayan organizmalara zararı nedeniyle 30 yıl sonra yasaklanmış, DDT kullanıldığı sürede sıtmadan ölümler önemli ölçüde azalmış ancak yasaklandıktan sonra çok büyük oranda artmıştır. Öte yandan sıtma etmeninin taşıyıcısı sivrisineklerde DDT ve diğer grup insektisitlere direnç evrimi de savaş gücümüzü azaltmıştır. Burada sözünü etmek istediğim bir başka hastalığa, orak hücre anemisine neden olan gen bakımından heterozigot olan bireylerin sıtmaya karşı dirençli olmaları olgusudur. Hemoglobin molekülünü kodlayan gende mutasyon sonucu hemoglobinde bir amino asitin değişmesiyle orak hücre anemisine neden olan bu genetik değişim heterozigot bireylerin sıtmaya dirençli olmalarını sağlamaktadır. Sıtmanın yaygın olduğu bölgelerde yaşayan insan toplumlarında seçilim işlemekte ve orak hücre anemisi alelinin sıklığı artmaktadır. Dahası aynı lokusta bir üçüncü alel –aynı pozisyonda başka bir amino asit ornatmasına neden olan- sıtmaya karşı insanları, orak hücrelilere kıyasla daha dirençli kılmaktadır ve bu alelin sıklığı bazı batı Afrika toplumlarında hızla artmaktadır. Artışın bir nedeni hemoglobin C’nin hemoglobin S’ye kıyasla daha hafif kansızlığa neden olmasıdır. Araştırmacılar bu nedenle sıtmanın kökü kazınmadığı sürece gelecek birkaç bin yılda batı Afrika’da Hb-C’nin Hb-S’nin yerine geçeceğini ve baskın sıtma-karşıtı hemoglobin olacağını öngörmektedirler (Hedrick, 2006). Benzer şekilde thalassemi hastalığı taşıyıcıları –heterozigotları- nın da sıtmaya karşı dirençli oldukları saptanmıştır. İlaveten β-thalassemi taşıyıcılarının koroner kalp hastalıklarına karşı da koruyuculuğu olduğu ortaya konulmuştur. Bu koruyuculuk özelliği, thalassemi hastalarına seçici yaşayabilme üstünlüğü kazandırmaktadır. Bu örnekte de Darvinsel evrimin süreçleri açıkça gözlenmektedir; mutasyon → varyasyon → seçilim → uyarlanma = evrim
4. Bitkilerde direnç: Son yıllarda artan bilimsel araştırmalar bitkilerde de hastalıklara, ağır metallere ve herbisitlere karşı direnç genlerinin bulunduğu ve bu genlerin dengeleyici seçilim ile populasyonlarda belli bir sıklıkta sürdürüldüğüne cok fazla örnek vardır. Bunlardan bir tanesi Arabidopsis thaliana bitkisinde hastalık yapıcı, Pseudomonas bakterisine karşı dirençtir. Bitkide bu direnç Rpm1 geninin kodladığı bir hücre zarı proteininin değişimi ile ortaya çıkmaktadır
(Stahl et al., 1999).
Herbisit direnci:Yaygın kullanılmakta olan glyphosate herbisitine karşı direnç geliştiren en az 8 yabani ot türü bilinmektedir. Bir çok ülkede bazı zararlı ot populasyonları bu herbisite hedef enzim direnci göstermekte, 5-enolpyruvylshikimate-3-phosphate synthase (EPSPS) enziminde 106. amino asitin değişmeleriyle direnç kazanılmaktadır. Mutasyonlar, 106. amino asidi prolinden serin ya da treonine değiştirmekte ve EPSPS enzimini glyfosata dirençli kılmaktadır. Aynı zamanda ABD ve Avustralya’da hedef enzimle ilgili olmayan glyphosate direnç mekanizması da atotu ve karaçayır populasyonlarında saptanmıştır. Bu mekanizmayla bu herbisitin meristematik dokulara nakli azalmıştır. Her iki mekanizma da bir gen ile kalıtlanmaktadır. Zararlı otlarla savaşımda bu herbisite gereksinim artmakta iken direnç gelişimi bu değerli herbisit kaynağının sürdürülebilirliğini tehlikeye atmaktadır (Ehrenreich and Purugganan, 2006; Service, 2007).
Farklı canlı türlerinde direnç evrimine bu örneklerin tümünde gözlenen, canlıların değişmeden kaldıkları savının geçerli olmadığıdır. Canlılar nasıl değişmeden, oldukları gibi kalabilirler? İçinde yaşadıkları çevre dinamik, koşulları değişen bir çevre ve insan etkisiyle hızlanarak değişen bir çevre. Bu değişime ayak uydurmak canlılar için olmazsa olmaz. Ya değişerek uyum sağlayacak ya da değişmeyip yok olacak. Evrimin ne olduğunu, nasıl olduğunu araştıralım, öğrenelim ve öğretelim ki türümüzün ve bağımlı olduğumuz diğer canlı türlerinin yaşamlarını sürdürebilmeleri için gerekli bilgi donanımına sahip olabilelim.
Direnc oluşumunu çalışmak, araştırmak, evrimin işleyişini kavrama, seçilimi etkileyen etmenler olarak, mutasyonların etkileri, gen baskınlığı-çekinikliği, gen akışı, gen etkileşimleri, uyum ödünleri gibi ve hatta evrim kuramının sınanması için bir fırsat olmaktan öte kontrol stratejilerinin belirlenmesi ve direncin evriminin ertelenmesi ya da geri döndürülmesi için strateji geliştirmek ancak evrimin ilkelerine dayandırılarak yapılabileceğinden acil ve yaşamsal önem taşımaktadır. Gelişmiş ülkelerdeki evrim bölümlerininn, evrim araştırma enstitülerinin artan sayısı, evrim araştırmalarına ayrılan kaynakların büyüklüğü, hızla artan bilimsel yayınlar, ve bu bilgilerin tarımda, tıpta uygulanmaları, doğal seçilimle evrim olgusunu reddetme ve bu alanda araştırma yapmayı engelleme ya da teşvik etmeme yaklaşımının olanaklı ve akıllıca olmadığını çok açık göstermektedir. Orta öğretimde evrim konusunun salt bilimsel yaklaşımla öğretilmesi bilime saygının gereğidir. Üniversitelerde ise biyoloji bölümlerinde ve diger ilgili bölümlerde bir evrim dersi bulunmaması en azından öğrencilere yapılan haksızlıktır.
Kaynaklar:
Normark BH, Normark S. Evolution and spread of antibiotic resistance.
J Inter Med 2002;252(2):91– 106.
Gilmore MS., & Hoch, JA. 1999. Antibiotic Resistance:A vancomycin surprise. Nature 399:524-526.
Bunch A & Baines, A. 1997. Vancomycin- a vital antibiotic. Molecule of the month, July, 1997.
Fournier, D., Bride, J-M., Hoffmann, F., Karch, F. 1992. Acetylcholinesterase. Two types of modifications confer resistance to insecticide. Journal of Biological Chemistry 267(20):14270-14274.
Fournier, D., Mutero, A., Palavorio, M., Bride, J-M. 1993. Drosophila acetylcholinesterase: Mechanisms of resistance to organophosphates. Chemico-Biological Interactions 87(1-3):233-238.
Seino, A., Kazuma, T., Tan, A.J., Tanaka, H., Kono, Y., Mita, K., Shiotsuki, T. 2007.Analysis of two acetylcholinesterase genes in Bombyx mori. Pesticide Biochemistry and Physiology 88(1):92-101.
Nabeshima, T., Kozaki, T., Tomita, T., Kono, Y. 2003. An amino acid substitution on the second acetylcholinesterase in the pirimicarb-resistant strains of the peach potato aphid, Myzus persicae. Biochemical and Biophysical Research Communications 307 (1):15-22.
Nabeshima, T., Mori, A., Kozaki, T., Iwata, Y., Hidoh, O., Harada, S., Kasai, S., (...), Tomita, T. 2004. An amino acid substitution attributable to insecticide-insensitivity of acetylcholinesterase in a Japanese encephalitis vector mosquito, Culex tritaeniorhynchus. Biochemical and Biophysical ResearchCommunications 313 (3):794-801.
Walsh, S.B., Dolden, T.A., Moores, G.D., Kristensen, M., Lewis, T., Devonshire, A.L., Williamson, M.S. 2001. Identification and characterization of mutations in housefly (Musca domestica L.) acetylcholinesterase involved in insecticide resistance. Biochemical Journal 359 (1):175-181.
Ni, X.-Y., Tomita, T., Kasai, S., Kono, Y. 2003. cDNA and deduced protein sequence of acetylcholinesterase from the diamondback moth, Plutella xylostella (L.) (Lepidoptera: Plutellidae). Applied Entomology and Zoology, 38 (1):49-56.
Georghiou, G.P.& Lagunes-Tajeda, A. 1991. The occurrence of resistance to pesticides in Arthropods. Food and Agriculture Organization of the United Nations, Rome.
World Health Organization.
Futuyma, D.J. 2007. Evolution, Science & Society: Insect pests: Resistance and management. Evolutionary Biology and the National Agenda.
Ranson H, Claudianos C, Ortelli F, Abgrall C, Hemingway J, et al. 2002. Evolution of supergene families associated with insecticide resistance. Science 298:179–181.
Taşkın, V., & Kence, M. 2004. The genetic basis of malathion resistance in housefly (Musca domestica L.) strains from Turkey. Russian Journal of Genetics (40):1215-1222.
Hedrick, P.W. 2006. Genetic polymorphism in heterogeneous environments: the age of genomics. Annu. Rev. Ecol. Evol. Syst. 37:67-93.
113
Garrigan, D. & Hedrick, P.W. 2003. Perspective:detecting adaptive molecular evolution, lessons from the MHC. Evolution 57:1707-22.
Service, R.F. 2007. A growing threat down on the farm.Science 316(5828):1114-1117. Stahl, E.A., Dwyer, G., Mauricio, R., Kreitman, M., Bergelson, J. 1999. Dynamics of disease resistance polymorphism at thr Rpm1 locus in Arabidopsis. Nature 400:667-671. Ehrenreich, I.M. and Purugganan, M.D. 2006. The molecular basis of plant adaptation. Special Paper. American Journal of Botany 93:953-962.


















0 Yorumlar